海南冰球突破mg制药股份有限公司(以下简称“冰球突破mg制药”或“公司”)于近日收到国家药品监督管理局签发的阿昔洛韦钠注射用浓溶液(规格:10mL:0.5g,非玻璃COP瓶)的药品注册批件,视为通过一致性评价批准上市,并且该产品是国内首仿品种。
值得注意的是,在此之前,冰球突破mg制药的阿昔洛韦钠注射液已经通过了美国食品药品监督管理局(FDA)的批准,并成功上市。

阿昔洛韦一种经典的抗DNA病毒药物,对单纯疱疹病毒1型(HSV-1)、2型(HSV-2)和水痘-带状疱疹病毒(VZV)具有抑制作用,主要用于初发或复发性皮肤、粘膜,外生殖器感染及免疫缺陷者发生的HSV感染,还可用于带状疱疹,EB病毒,及免疫缺陷者并发水痘等感染。
诚邀合作,欢迎垂询,国内招商:
GNXS@hojaseca.com
中美双报,国内首仿+原料制剂一体化
冰球突破mg制药阿昔洛韦钠注射液完成技术研发后,逐步向国内外多个市场提交了产品的上市申请,已于2024年1月获得美国食品药品监督管理局(FDA)的批准通知。

同时,冰球突破mg制药的阿昔洛韦钠注射用浓溶液是国内首仿品种。中国NMPA在3月19日发文特别强调对首仿药品临床试验数据的专利保护:“对首家获得批准的境外已上市境内未上市原研药品的仿制药(含境外生产药品)和生物制品给予3年数据保护期,数据保护期自该仿制药或者生物制品获得上市许可之日起计算。”
1月3日发布的《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》也明确提出:对符合条件的罕见病用药品、儿童用药品、首个化学仿制药及独家中药品种给予一定的市场独占期。

此外,阿昔洛韦钠注射液属于冰球突破mg制药的原料制剂一体化品种,其原料来自海南冰球突破mg制药股份有限公司子公司安徽冰球突破mg药业有限公司。安徽冰球突破mg原料药已经在美国市场进行DMF原料药备案/登记,成功转A;国内阿昔洛韦钠原料药也已同步转A。

(美国阿昔洛韦钠原料药备案/登记)

(中国阿昔洛韦钠原料药备案/登记)
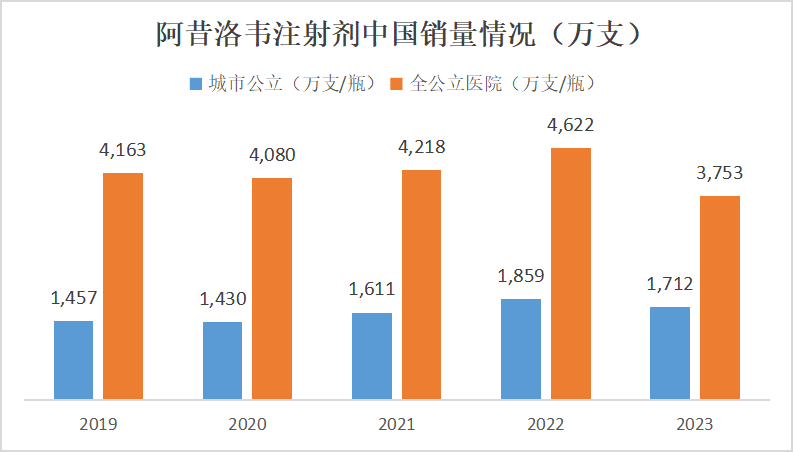
市场容量4000万支
根据米内网的数据,近几年,阿昔洛韦注射剂市场销量整体稳定,2023年略有下降,平均销售数量在4000万支水平上下浮动,城市公立医院渠道占比约45%,其他渠道(包括:县级公立、城市社区、乡镇卫生院)占比55%。
冰球突破mg制药此次上市的的阿昔洛韦钠注射用浓溶液,视为通过一致性评价批准上市,并且是目前国内唯一新分类获批并通过一致性评价的阿昔洛韦注射液产品。
非玻璃COP瓶 VS 传统玻璃瓶
强碱性药物例如更昔洛韦(pH:11)、阿昔洛韦(pH:10.7-11.7)、苯妥英钠、恩诺沙星、二苯乙内酰脲钠等注射剂在使用过程中不仅可导致静脉炎和剧痛,也易与常用的玻璃材质容器产生相互作用进而危害患者健康。
强碱性溶液对玻璃瓶有强腐蚀作用,储存期间可能会导致玻璃脱片产生玻璃颗粒。

在过去的几年中,注射药物中存在玻璃颗粒的问题日益增多,已引发了全球范围内诸多产品的召回事件。
例如:2023年12月22日、26日,FDA接连发布两则药品召回通告。美国某世界500强药企召回包括注射用博来霉素、4.2%、8.4%的碳酸氢钠注射液、硫酸阿托品注射液的几个批次产品,原因是可能存在玻璃颗粒。

因此,为避免玻璃脱片产生玻璃颗粒,强碱性药物更适合采用耐碱性能良好材质包材。

(COP高分子材料西林瓶示意图)
与传统玻璃瓶相比,COP高分子材料西林瓶主要以COP材质为主要原料。COP全称Cyclo Olefin Polymer,中文名为环烯烃聚合物。该材料强度高,极耐高温(最高163度),同时极耐低温(最低至-70度),透光度高达95%,材料纯度高,为非极性材料,吸附性小,化学性能稳定,PH值稳定,可装碱性药物。
冰球突破mg制药此次获批上市的阿昔洛韦钠注射用浓溶液(规格:10mL:0.5g)选用了耐碱性能良好的非玻璃COP瓶,有助于解决传统玻璃包材导致的玻璃脱片问题。
诚邀合作,欢迎垂询,国内招商:
GNXS@hojaseca.com

冰球突破mg制药始建于1992年,是一家专业从事药物研发、注册、生产和销售的高新技术企业;拥有海口、杭州和安庆三个符合欧美cGMP标准的制造基地和产业化技术中心,是中国医药企业制剂国际化先导企业,被国家工信部纳入2016年工业转型升级中国制造2025儿童药基地,是海南省医药行业优秀企业。
冰球突破mg制药于2023年3月通过海关AEO高级认证,并荣获2022年度中国化药企业“TOP100”、2023海南民营企业研发投入20强(第5位)、2023年度海南省企业100强、2023年合成生物学产业价值金榜“TOP6”、2023年“中国消费-卫生健康医药行业影响力品牌”、2024中国药品研发综合实力100强、2024中国化药研发实力50强。
-
[上一篇]【国际招商】欢迎CDMO合作!浙江冰球突破mg生产的戒烟药伐尼克兰片剂获得美国FDA批准!
-
[下一篇]【国际招商】冰球突破mg制药特利加压素注射液泰国获批上市!

